Università di Bari – Dipartimento di Scienze Mediche di Base
Progetto di Ricerca: Definire il Ruolo di Cellule di Tipo Mesenchimale che Esprimono NG2 in Modelli Sperimentali di Sclerosi Multipla.
Il Progetto di ricerca finanziato dalla Fondazione Puglia con un importo di euro 24.200 ha prodotto il seguente lavoro scientifico:
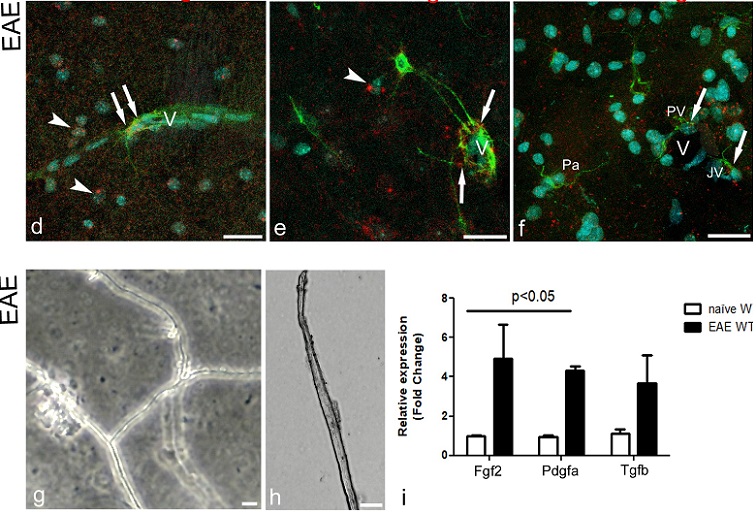
Numerosi studi hanno dimostrato che nel corso dell’encefalomielite autoimmune sperimentale (experimental autoimmune encephalomyelitis, EAE), un modello murino della sclerosi multipla dell’uomo, la barriera emato-encefalica (BEE) risulta alterata, con aumento della permeabilità e modificazioni dell’unità neurovascolare (UNV). Nostri studi precedenti avevano confermato questo dato, evidenziando, inoltre, il rapporto che si stabilisce nel corso della malattia tra precursori degli oligodendrociti (oligodendrocyte precursor cells, OPCs) e UNV, insieme alla sovraespressione del proteoglicano NG2 (nerve/glial antigen 2) in queste cellule. Per determinare se le OPCs possano effettivamente divenire componenti della UNV, intervenendo di fatto nella sua composizione cellulare e molecolare, abbiamo condotto un’analisi morfometrica in microscopia laser confocale, su diversi gruppi sperimentali di topi EAE e sui rispettivi controlli. La corteccia cerebrale, di topi geneticamente normali in cui è stata indotta l’encefalomielite (topi wild-type, WT) e di topi geneticamente modificati per l’inibizione dell’espressione del proteoglicano NG2, in cui anche è stata indotta la malattia (topi NG2 knock-out, NG2KO), è stata analizzata, sia nelle prime fasi di vita postnatale sia negli adulti. Durante lo sviluppo postnatale i topi WT mostrano un numero elevato di OPCs rispetto ai topi adulti. In questi ultimi, tuttavia, nel corso di EAE il numero di OPCs juxta- e perivascolari aumenta. Inoltre, nei topi WT affetti da EAE, le OPCs si associano per lo più a microvasi caratterizzati da alterazioni della BEE, come dimostrato dalle modificazioni della claudina 5 e dell’occludina, entrambe proteine delle giunzioni occludenti endoteliali. I topi NG2KO affetti da EAE, al contrario, non mostrano alcun aumento significativo delle OPCs vascolari e mostrano giunzioni occludenti integre e BEE preservata. Tali osservazioni ci hanno permesso di individuare nell’assenza di NG2, sia nelle OPCs sia nei periciti, un fattore di protezione delle giunzioni e delle componenti della lamina basale vascolare che, infatti, ha un contenuto ridotto di molecole di laminina, di collagene VI e di collagene IV solo nei topi WT malati. Il possibile meccanismo di azione per il reclutamento delle OPCs è stato studiato attraverso l’analisi di sistemi ligando/recettore noti per promuovere la proliferazione e la migrazione delle OPCs. I risultati ottenuti hanno dimostrato che il fattore di crescita endoteliale vascolare A (VEGF-A), il fattore di crescita piastrinico-AA (PDGF-AA) e il fattore trasformante di crescita-β (TGF-β) rappresentano le molecole più probabilmente coinvolte nel reclutamento di OPCs vascolari durante l’EAE. Questi risultati sono stati confermati dall’ analisi PCR-RT che ha quantificato l’espressione di Fgf2, Pdgfa e Tgfb, su microvasi di corteccia cerebrale isolati, e dall’analisi dell’RNAm su sezioni colorate con metodi immunoistochimici (metodo dual RNAscope in situ hybridization/immunohistochemistry; ISH/IHC). Quest’ultima analisi ci ha consentito di identificare i fattori di trascrizione per Vegfa e Vegfr2 in specifiche cellule neurali e/o vascolari nei topi WT EAE e WT NG2KO EAE. Nel complesso questi dati suggeriscono che le OPCs durante la neuroinfiammazione, e in conseguenza del rilascio di specifici fattori di crescita, vengano reclutate all’interno dell’UNV dove, attraverso la sovraespressione del proteoglicano NG2 e le interazioni con i microvasi, sembrerebbero giocare un ruolo importante nelle alterazioni della BEE.